研究内容proJECT
分子医療・ゲノム創薬学研究室は、高等生物と近い細胞内シグナル伝達経路をもつ分裂酵母モデル生物を用いて、RasやMAPキナーゼ、カルシニューリンなど細胞増殖や癌化・免疫に関わる細胞内シグナル伝達経路を中心に、最先端のゲノム薬理学、ケミカルバイオロジー、分子細胞生物学、分子遺伝学、ゲノム創薬の手法を用いて研究を行っています。
分裂酵母はヒトに最も近い単細胞生物で,世代時間が短く、ゲノムサイズが小さいため、哺乳動物細胞では考えられない非常にパワフルな分子遺伝学的・ゲノム薬理学的アプローチが可能です。
また、モデル生物を用いた創薬アプローチにより、全く新しいメカニズムの抗がん薬シーズを探索、開発しています。
モデル生物を用いて得られた成果を、哺乳動物細胞やノックアウトマウスなどの系で検証し、高等生物に還元することも行っています。
主な研究内容は
1) ゲノム薬理学の手法を用いたMAPキナーゼシグナル制御因子の同定
2) MAPKシグナルとmRNA結合タンパク質制御の関わり
3) ケミカルバイオロジーの手法を用いた抗がん薬探索と開発
4) 細胞内輸送システムのゲノム薬理学的研究
これ以外にも、薬とゲノムに関わる面白いテーマが満載です
ゲノム薬理学の手法を用いたMAPキナーゼシグナル制御因子の同定
私たちは、免疫抑制薬タクロリムス(FK506)の標的分子であるカルシニューリン遺伝子が分裂酵母にも存在し、分裂酵母においても、カルシニューリンがFK506の標的分子であることに着目し、カルシニューリンノックアウト細胞の解析を行いました。そしてカルシニューリン遺伝子ノックアウト細胞が、正常細胞が生育できるような濃度のMgCl2添加培地で生育できなくなるという表現型を示すことを見出し、そこからカルシニューリンとMAPキナーゼの拮抗的な関係を発見しました(Sugiura et al., EMBO J. 1998)。そして、この関係を利用した分子遺伝学的スクリーニングを考案し、MAPキナーゼシグナルの制御因子を数多く同定しました。具体的にはMAPキナーゼを脱リン酸化することにより不活性化するMAPキナーゼホスファターゼをコードするpmp1+遺伝子(Sugiura et al., EMBO J. 1998)、MAPキナーゼキナーゼとしてMAPキナーゼをリン酸化し、活性化するpek1+(Sugiura et al., Nature. 1999)、そしてMAPキナーゼホスファターゼのmRNAに結合し、安定化することでMAPキナーゼを抑制するRNA結合タンパク質をコードするrnc1+遺伝子などです(Sugiura et al., Nature 2003)。
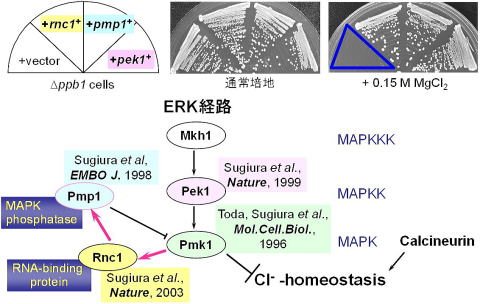
また、この手法を応用発展することにより、MAPキナーゼシグナルの新たな制御因子として、ファルネシル転移酵素Cpp1(Ma et al., Mol. Biol. Cell 2006)やMAPKの標的因子として転写因子Atf1, Mbx1を同定しました(Mol. Biol. Cell 2006, 2010)。
MAPKシグナルとmRNA結合タンパク質制御の関わり
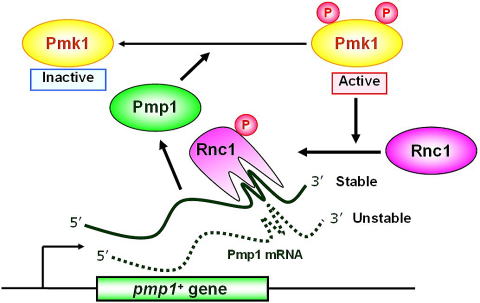
上記のカルシニューリンノックアウト細胞を回復するRNA結合タンパク質として同定したRnc1(RNA-binding protein that suppresses calcineurin deletion 1)は、当初RNA結合タンパク質をコードしているということ以外、全く手掛かりがつかめず、機能解析は難航しました。結果的には、Rnc1は、MAPキナーゼホスファターゼであるPmp1 mRNAと結合することにより、Pmp1を安定化することが明らかとなりました。すなわち、Rnc1を過剰発現させるとPmp1が安定化し、Pmk1 MAPキナーゼが抑制されます。従ってRnc1というRNA結合タンパク質は、MAPKホスファターゼmRNAの安定化を介してMAPキナーゼシグナルを負に制御するということが証明できました。
さらに興味深いことに、Rnc1には6ヶ所のMAPキナーゼによるリン酸化配列がありました。そこで、MAPキナーゼによってリン酸化される可能性を検証したところ、Pmk1 MAPキナーゼによってRnc1はリン酸化を受けることが明らかとなりました。しかも、Pmk1によってリン酸化されることにより、Rnc1のRNA結合能力が上昇することがわかりました。つまり、何らかの理由によって、MAPキナーゼが活性化するとRnc1をリン酸化し、リン酸化されたRnc1は、本来不安定なMAPキナーゼホスファターゼのmRNAに強く結合することにより、Pmp1を安定化します。すなわち、「RNA結合タンパク質を介するMAPキナーゼシグナルのnegative feedback制御」という全く新しい概念を提唱することができました(Sugiura et al., Nature 2003, Cell Cycle 2004)。
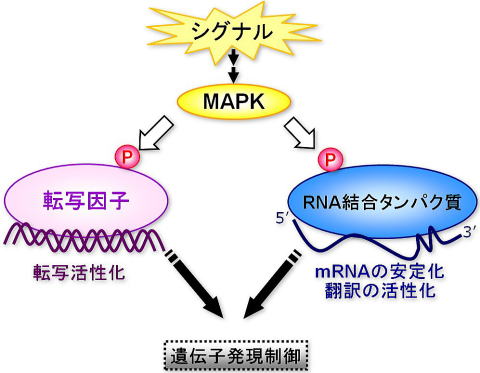
現在までに、サイトカイン、増殖因子、あるいはストレスなどの刺激はMAPキナーゼを活性化し、その過剰な活性化を打ち消すためにMAPキナーゼホスファターゼの発現を誘導することが知られています。このMAPキナーゼホスファターゼの発現レベルの上昇は、MAPキナーゼ依存的あるいは非依存的に未知の転写因子が活性化するためであろうと解釈されてきましたが、Rnc1の例からも、MAPキナーゼホスファターゼの遺伝子発現は、転写レベルのみならずmRNAの分解などの、「post-transcriptional」なメカニズムによっても制御されており、RNA結合タンパク質は、このステージにおいて主役であると考えています。
現在までMAPキナーゼ経路が遺伝子発現に与えることは良く知られていますが、そのほとんどが、MAPキナーゼが転写因子をリン酸化することにより転写の活性化を促進し、標的遺伝子群の発現レベルに影響を与えると解釈されてきました。しかしながら、私たちの研究のみならず、高等生物においても、MAPキナーゼが直接的に、あるいは間接的にtristetraprolinやhnRNP-KなどのRNA結合タンパク質をリン酸化し、その機能や局在を調節することにより、mRNAの安定性あるいは翻訳の効率を促進するという報告が数多く認められています。このように、RNA結合タンパク質はMAPキナーゼの標的として、また細胞内シグナル伝達経路における重要なプレーヤーとして生命現象の鍵を握っていると考えられます。
ケミカルバイオロジーの手法を用いた抗がん薬探索と開発
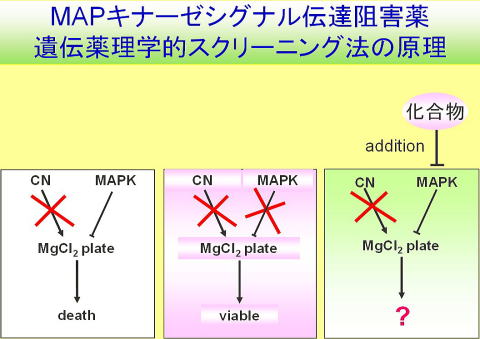
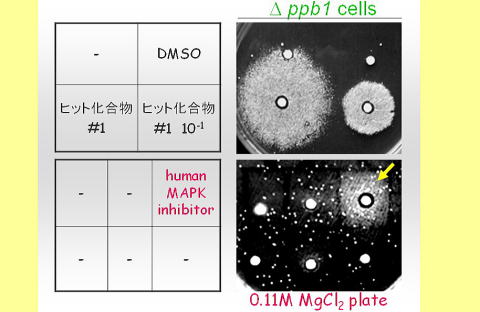
マップキナーゼ(MAPK)シグナルは細胞増殖や癌化に重要な役割を果たすことから、抗がん薬創製の魅力的なターゲットであり、その制御機構の解明は、癌化の理解に直結する重要な研究課題である私たちは独創的な<ゲノム薬理学>を用いた戦略により、MAPキナーゼシグナルインヒビターをハイスループットにスクリーニングするシステムを開発し、全く新しい作用機序により抗がん活性を有する化合物の同定に成功しました。
本研究ではこれまでの成果をさらに発展させ、大規模化合物ライブラリーのハイスループットスクリーニングによるMAPKシグナル伝達阻害薬の探索を行うとともに、 取得したヒット化合物の分子標的の同定と作用機序の解明を行い、モデル生物研究から浮かび上がった先駆的な知見を、ノックアウトマウスやRNAiなどの手法を用いた哺乳動物細胞のシグナル伝達系で検証・還元することにより、 革新的ながん治療法の開発とともに、MAPKシグナルネットワーク制御機構の解明を目指しています
細胞内輸送システムのゲノム薬理学的研究
細胞内で物質や脂質を運ぶ際には、小胞体からゴルジへ、そしてゴルジから細胞膜へと輸送物質が運ばれます。物質の運搬は様々なタンパク質が関わりながら、リレーのような形で、物質の受け渡しを行います。物質の運搬がうまくいかないと、細胞の形が異常になり、細胞のがん化にもつながります。
低分子量Gタンパク質Rhoは、細胞内で様々な標的タンパク質との連携により、物質運搬の鍵を握る重要なタンパク質ですが、その仕組みの多くは謎に包まれていました。また、人においてRhoの働きが異常になることで、細胞骨格・形態の異常やがん化が引き起こされることから、Rhoの働きに狙いを絞った薬物の開発は、抗がん薬の創製という意味からも注目されています。
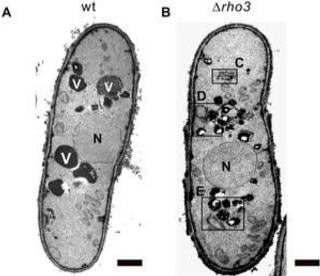
私たちは、現在までにクラスリンアダプター複合体が細胞内の物質運搬に重要であることを突き止めており、新たにRhoの一種であるRho3とクラスリンアダプター複合体が協力しながら、ゴルジ体における物質の運搬を調節するという仕組みを見つけました。
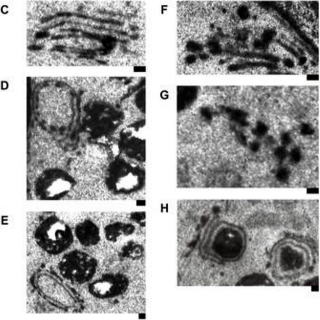
電子顕微鏡を用いてRho3ノックアウト細胞を高解像度で細胞の構造を観察したところ、異常に肥厚したゴルジ体や、運搬されない物質がゴルジ体の近くに蓄積していることも明らかにしました。これは、Rho3タンパク質がゴルジ体の物質の運搬に重要な役割をしていることを強く示唆しています。しかも、クラスリンアダプター複合体とRho3は、どちらもゴルジ体に局在し、結合することも明らかにしました。
Rho3は、分裂酵母のタンパク質ですが、人間にもRho3と非常に良く似たRhoタンパク質が存在し、物質の運搬や細胞の形態形成、がんの発症や転移に関わっているため、細胞のがん化や転移の仕組みを解明し、Rhoを標的とした新しい抗がん薬創製の手がかりとなる可能性があると考えています。
分子医療・ゲノム創薬学研究室
〒577-8502
大阪府東大阪市小若江3-4-1
近畿大学薬学部
分子医療・ゲノム創薬学研究室
TEL 06-6721-2332(内線3850)
FAX 06-6730-1394