ヒト脂肪を利用した、臨床に有用な細胞資源の開発
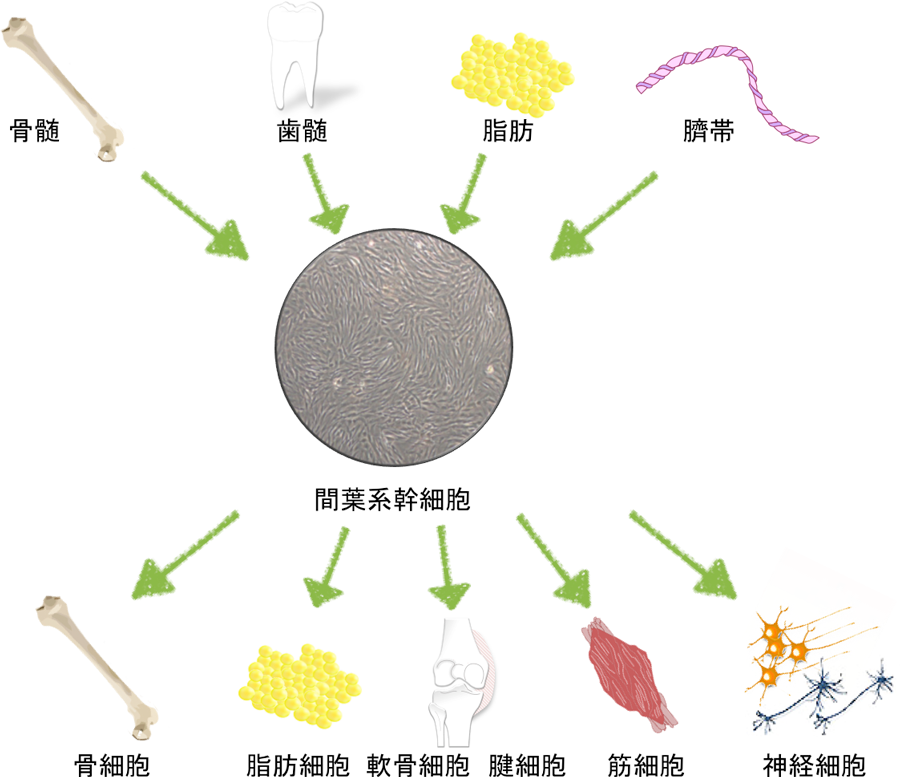
私たちは、幹細胞生物学の基礎研究に取り組み、その成果を実用化研究に橋渡しする革新的な再生医療研究を推進しています。現在、その研究素材として着目しているのがヒト体性幹細胞(組織幹細胞)のひとつである「間葉系幹細胞」です。なかでも、ヒト脂肪組織に含まれる間葉系幹細胞(hASC: human Adipose-derived Stromal/Stem Cell)を用いて研究の歩を進めています。hASCは、脂肪、骨、軟骨などの間葉系組織みならず、神経、肝臓、膵β細胞、心筋などの内・外胚葉系組織など含む、さまざまな細胞に分化する能力を有していることが分かっています。また、ヒトがもつ様々な脂肪部位(皮下脂肪など)より、大がかりな採取を経ることなく低刺激な様態(低侵襲性)にて、数的にも大量に分取できるといった利点があります。そのため、例えば、細胞再生治療の原材料として、創薬の被検細胞として、美容医療の細胞原材としてなど、有用性のみならず実用性が最も高い幹細胞種と位置づけられているのです。しかしながら、この有用性や実用性の一方、hASCの性質や真の正体は未だ解明されていないという現状があります。私たちは、この不確かさのひとつひとつを明らかにすることで、hASCの正体を見つけ出す研究を続けています。
1. より質の高いヒト脂肪由来間葉系幹細胞の樹立を目指す
私たちは、生体内で最も高い活性状態を維持するhASCを取り巻いている環境要因に着目しています。例えば、生体内におけるhASCが受けるストレス(酸素濃度、栄養および浸透圧などによる環境ストレス等)、これらがhASCの増殖能や未分化性維持にどのような影響を及ぼすかについて精緻に解析しています。hASCを取り巻く体液や細胞間における酸素濃度の観点に着目した研究では、より厳密に酸素濃度(溶存酸素濃度)をコントロールすることで、hASCの増殖性、未分化性が著しく向上すること、およびそれらの制御分子の存在を見出しました(Stem Cells Dev. 23(18):2211-24 (2014)、特開2014-030423)。
2. 間葉系幹細胞のもつstemness、未分化性維持、多分化能メカニズムの解析
生体内ストレスおよび生体内環境要因に曝された幹細胞の中ではどのような現象が引き起こされているのか。それは、生体内という至適な環境に存在するhASCにおいて、本質的にどのような意味をもっているのか。私たちはそのメカニズムを探るべく、in vitro解析はもちろんのこと、ex vivo解析としての組織培養、新規3次元培養、in vivo解析としてのマウスエンジニアリングを駆使し、幹細胞が本来有する能力・幹細胞内+外(生体内環境)のダイナミズムを明らかにしていく研究をおこなっています。生体内環境で重要な要素である酸素濃度については、既に重要な因子を解析可能な範囲で数点しぼりこんでおり、その解析と生物学的理論を立証する基礎データを得ています。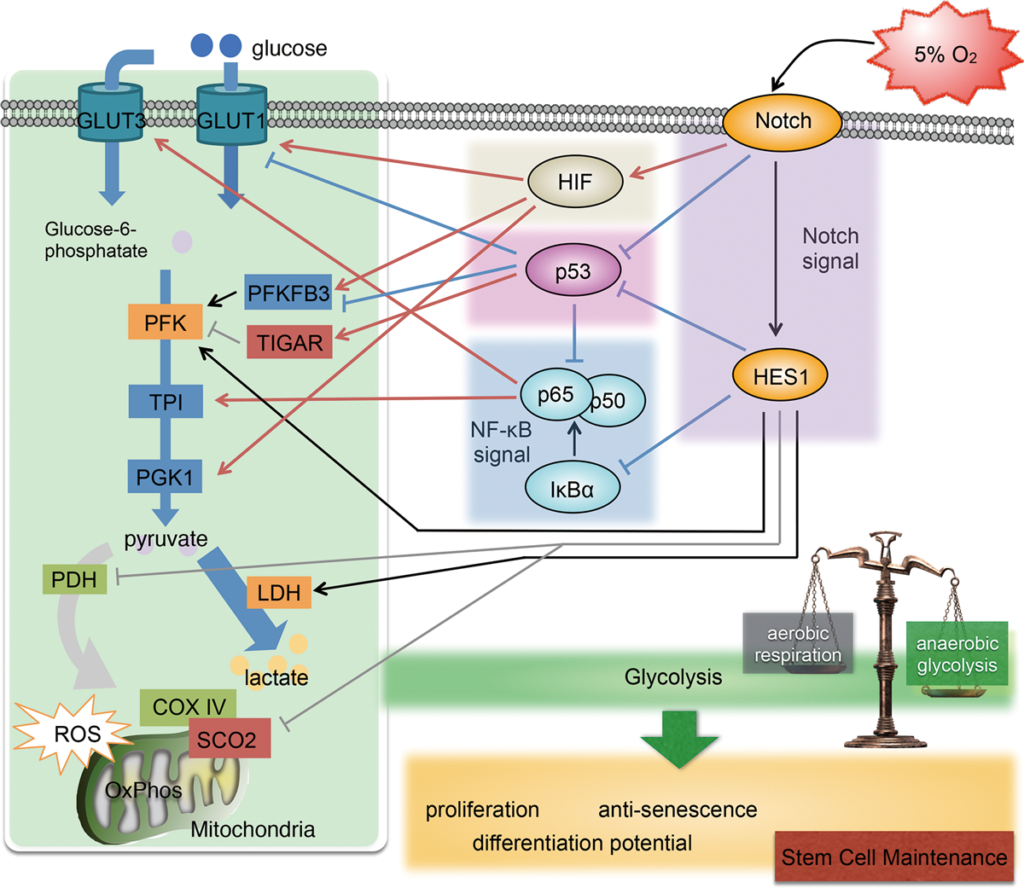
私たちの見出した重要な因子の一つがNotchシグナルです。hASCを生体内と同等の酸素濃度で培養すると、解糖系が更新することが認められました。このとき、これらの集団では、低酸素応答因子HIF非依存的なNotchシグナルの活性化が引き起こされることを発見しました。詳しい解析の結果、Notchシグナルは解糖系亢進に関与するトランスポーター等の発現上昇、解糖系抑制に関与する酵素群の発現抑制に関与することが明らかとなりました。これらは、Notchシグナルによるp53シグナル経路の抑制、NF-κBシグナルの活性化、HIFの転写活性亢進により制御されていたのです。図に示すように、Notchシグナルは複雑なシグナル制御により、細胞の代謝を制御し、幹細胞性の維持に関与しているということです(Stem Cells Dev. 27(13): 935-947 (2018))。
このように、幹細胞の持つ特性を分子基盤として提唱し、臨床の現場で安心・安全・操作性・フットワークの最良な”使える幹細胞”を提供することにつなげていくことを目指します。同時に、この研究から導き出される成果物は、難病や難治性疾患に対する創薬ターゲットの切り口および、時間空間的に最適な創薬研究資材を提供することに直結すると期待しています。
3. 酸化ストレスを利用したhASC産生サイトカインによる分化誘導法の開発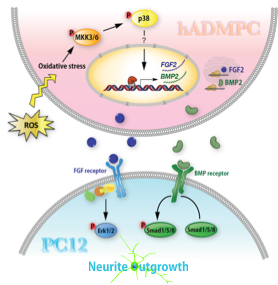
hASCに酸化ストレスを与えることにより、BMP2、FGF2をはじめとした、各種サイトカインの分泌量が著しく増加することを発見しました。酸化ストレスを与えたhASCの培養上清で神経の未分化細胞を培養すると、神経突起が伸び、神経に分化することが分かりました (BMC Cell Biol. 13(1): 21. (2012))。これらの技術は、脳梗塞など、病変部位が酸化ストレスに侵されているような疾病の治療に役立つのではと考えています。
また、BMP2は骨をはじめとした様々な細胞の分化にも関与していることが知られているため、hADMPCに酸化ストレスを負荷し、これらの細胞への高効率で安全な分化誘導法を開発することを目標にしています。
4. 遺伝子導入を利用した、分化誘導法の開発
hASCに分化誘導因子を導入することで、治療に有用な細胞を作り出すことが可能となります。そのため、hASCに効率良く導入出来、発現誘導が可能なレンチウイルスベクターを新規に開発しました(Plos ONE, 8(6): e66274. (2013))。
このレンチウイルスベクターを利用して膵臓のインスリン産生細胞やドパミン産生細胞などを作り出すことにより、糖尿病、パーキンソン病治療に役立つ細胞を開発したいと考えています。
5. hASCを用いた皮膚再構成
後述する私たちの皮膚科学研究を活かし、間葉系幹細胞から皮膚を再構成するための研究にも取り組んでいます。
- 真皮・皮下組織代替品としてのhASC
hASCを真皮代替品、hASCより分化誘導した脂肪細胞を皮下組織代替品とした皮膚三次元モデルの構築を試みています。現在までに、hASC、脂肪細胞を皮下組織代替品とした三次元構築モデルでは、表皮の厚みが有意に増加することを見出しており、hASCがヒト表皮角化細胞どのような影響を与えるのか、詳しく解析を進めています(論文投稿準備中・企業との共同研究)。
- 皮膚構成品としてのhASC
hASCはさまざまな細胞に分化する能力を秘めていると報告されています。そのため、皮膚構成細胞、例えばメラノサイトやケラチノサイト、神経、血管内皮細胞をhASCによって補完することも可能であると考えられます。また、hASCを含む間葉系幹細胞(MSC)投与により、MSCが損傷部位に遊走され、ケラチノサイトや血管内皮、筋繊維芽細胞などに分化することで、創傷治癒に寄与するという報告もあります。このようなhASCをひとつの原材料として皮膚構成細胞をパーツとして誘導できれば、個々人に応じたオーダーメイドの細胞および皮膚組織の提供も可能となるかもしれません。
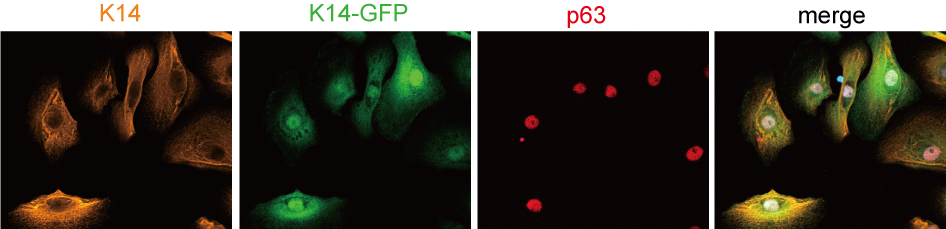
iPS細胞から誘導したケラチノサイト
ただし、直接的に分化させることが可能であっても、現段階ではiPS細胞のような分化効率には至らないのが実情です。そこで、まずはiPS細胞の出番です。hASCは未分化であり、増殖が早く、患者さんから低侵襲性にて採取できるため、iPS細胞の材料としても魅力的です。私たちは、皮膚疾患患者さん由来iPS細胞をhASCより樹立し、メラノサイトやケラチノサイトへの分化誘導にも成功しています。現在は、正常な表皮角化細胞をより効率よく分化誘導するための研究を進めています(大阪市立大医学部との共同研究)。
皮膚科学研究
私たちは、皮膚科学の基礎研究にも取り組んでいます。その成果の一部は、すでに実用化研究にも応用されています。皮膚はからだの中で最も大きな臓器です(最近では間質が最大という考えもあります)。皮膚には、外界からの刺激から私たちのからだを守ったり、体温を調節したり、水分・体液が失われないようにするなど、とても大切な働きを担っています。それだけでなく、皮膚は外観や容貌にも影響し、社会的なコミュニケーションにおいても大切な一面をもっているのです。このように、私たちにとってとても身近で大切な臓器、皮膚について、以下のような研究を行っています。
1. 皮膚表皮細胞の分化機構の解明
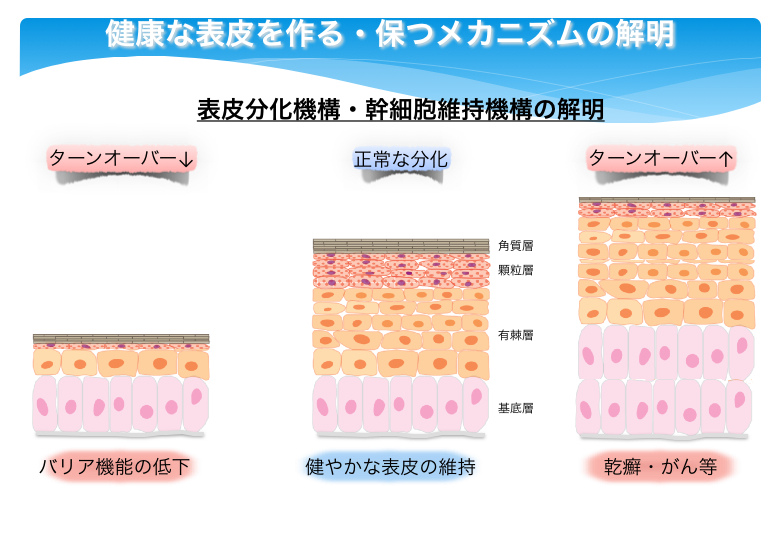 皮膚は表皮、真皮、皮下組織から構成されています。なかでも、表皮は、幹細胞・未分化細胞を含み活発に増殖する基底層 (basal layer)、細胞辺縁に棘状の突起が認められる有棘層 (spinous layer)、ケラトヒアリン顆粒をもつ顆粒層 (granular layer)、脱核・角質化した扁平な細胞からなる角質層 (cornified layer) の4層からなりたっています。基底層で分裂した細胞は体表面に向かって移動していき、有棘層、顆粒層、角質層へと分化し、やがて垢となって剥がれ落ちます。健康な表皮では、このような増殖(未分化性の維持)と分化の過程が厳密に制御され、その恒常性が維持されているわけです。では、こうした恒常性を保つために、一体どのような分子機構が働いているのでしょうか?
皮膚は表皮、真皮、皮下組織から構成されています。なかでも、表皮は、幹細胞・未分化細胞を含み活発に増殖する基底層 (basal layer)、細胞辺縁に棘状の突起が認められる有棘層 (spinous layer)、ケラトヒアリン顆粒をもつ顆粒層 (granular layer)、脱核・角質化した扁平な細胞からなる角質層 (cornified layer) の4層からなりたっています。基底層で分裂した細胞は体表面に向かって移動していき、有棘層、顆粒層、角質層へと分化し、やがて垢となって剥がれ落ちます。健康な表皮では、このような増殖(未分化性の維持)と分化の過程が厳密に制御され、その恒常性が維持されているわけです。では、こうした恒常性を保つために、一体どのような分子機構が働いているのでしょうか?
ひとつの答えがNotchシグナルです。Notchシグナルは表皮でとても複雑な働きをしています。私たちの以前の研究より、Notchシグナルは基底層から有棘層、有棘層から顆粒層への分化を促進する一方、Notchシグナルの下流で働くHes1が、有棘層から顆粒層への未成熟な分化を抑制していることが分かりました(Dev Cell. 134(6):1627-35 (2014))。つまり、Notchシグナルは有棘層の分化のタイミングを調節することで、表皮を適切な厚さに保つことが明らかとなったのです。
そこで、私たちは、Hes1の下流分子を探索しました。すると、Bnip3という、アポトーシスやオートファジーに関与する可能性のある分子が見つかってきたのです。表皮細胞の分化は脱核や細胞内小器官の消失を伴うことから、オートファジーの関与が示唆されていました。そこで、Bnip3の発現パターンや働きを詳細に調べたところ、Bnip3は顆粒層に発現し、ミトコンドリアをオートファジーにより分解することで、表皮の最終分化に関与していることが明らかとなったのです(J Invest Dermatol. 134(6):1627-35 (2014))。
2. 皮膚恒常性維持機構の解明
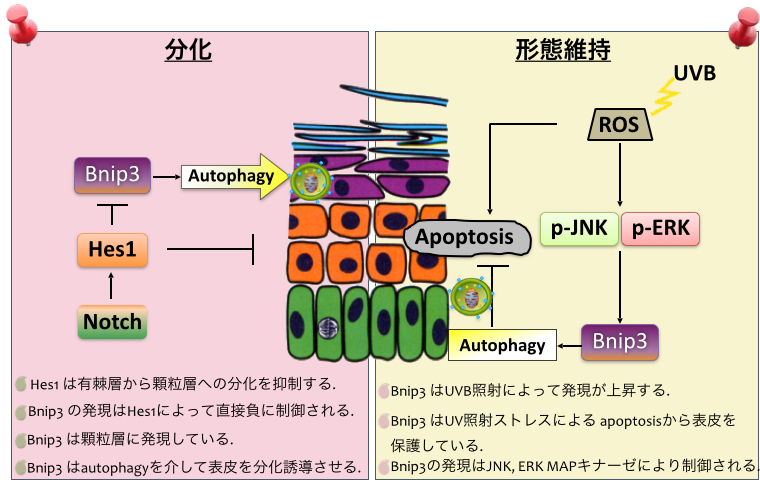
皮膚でのBNIP3の働き
皮膚はからだの最も外側にあるため、紫外線によるダメージや、擦り傷、切り傷などの外傷を受けやすい臓器です。私たちはこのようなダメージを受けた皮膚が、どのように恒常性を維持し、からだを守っているのかについても研究を行っています。
私たちの最近の研究により、これらのダメージから細胞を守るメカニズムのひとつに、オートファジーが働いていることが明らかとなってきました。皮膚表皮分化にも関与しているBNIP3をノックダウンした表皮三次元モデルを作成すると、死細胞が増えることに気づきました。そこで、この事象を詳しく調べたところ、紫外線によってBNIP3の発現が上昇し、ダメージを受けたミトコンドリアをBNIP3がオートファジーを引き起こして排除することで、表皮細胞をアポトーシスから保護することが明らかとなったのです (Cell Death Dis. 8(2):e2576(2017))。もちろん、紫外線によってダメージを受けた細胞が細胞死を免れてしまうことには不安があるかもしれませんが、
- 急激な日焼けなどで細胞が一気に死んでしまうと、皮膚のバリア機能が失われ、個体の死にもつながりかねない
- 紫外線によってBNIP3の発現が上昇しオートファジーが起こるのは幹細胞の存在する基底層より上の層であるため、ダメージの蓄積した細胞はいずれ垢となって剥がれ落ちる
ことから、このメカニズムによって皮膚の恒常性、ひいては個体の恒常性が守られているものだと考えられます。
現在は紫外線によるダメージからの防御機構だけでなく、切り傷などの外傷がなおるメカニズムにも焦点をあて、皮膚表皮だけでなく、真皮細胞に存在する線維芽細胞の働きについても研究をすすめています。
3. 香粧品への応用

皮膚の健常性のメカニズムを解き明かした研究成果などを受け、多くの企業様より共同研究の依頼をいただいています。そのひとつに香粧品原料候補の天然植物由来の成分や化合物の肌への効果の評価研究があります。例えば、アロエベラから抽出したエキスが皮膚の傷の治りを早くしたり、紫外線によるダメージから肌を守る効果があることを、細胞レベルで証明しています(Plos ONE. 11(10):e0164799 (2016), Bio Industry. 33(4):54-59 (2016), Bio Industry. 35(9):27-35 (2018))。また、ハス花等の混合植物エキスが表皮菲薄化を抑制する効果があることなども見出し、共同研究先の研究者が国内外の学会などにて発表を行なっています。
これらの研究成果は、香粧品がもつ機能性やヒト皮膚の健常性をサポートする妥当性の評価として活用されています。今後も、私たちの研究を基とした、新しい機能性香粧品が生まれることを期待し、このような側面から社会貢献していきたいと思っています。私たちの研究に興味をお持ちの企業の方からのご連絡もお待ちしています。
再生医療実用化のレギュラトリーサイエンス研究
基礎研究・臨床研究の成果を再生医療の現場で活用するには様々な過程を経て、長い時間をかけ審査される現状があります。この時間は、より効果的な再生医療を患者さんへ届けるために必ず必要となる時間であることはまちがいありません。ただし、この時間が大きな律速になってしまってはいけません。研究者はそのことに対して意識を働かせ、各々の研究成果を早く、広く実用化し社会貢献せしめる職責があります。しかしながら、多くの研究の現場では、実用化を意識した研究展開を成し得るのには困難な現状があります。その障壁のひとつが、成果を実用化に導く評価科学の難しさにあります。そのため、私たちは、根拠に元づく的確な予測・評価・判断科学技術の成果を人と社会との調和から人と社会との調和を考える再生医療実用化のためのレギュラトリーサイエンス(RS)研究も行っています。当分野での最高権威者のひとりである薬学総合研究所 元所長 早川堯夫先生のご指導のもと、再生医療分野、殊に幹細胞・皮膚科学を用いた再生医療に焦点を当て、私たちの成果を評価研究し、社会貢献に結びつけるRS研究も行っています。このようなRS研究成果が波及することで、国内で行われている多くの先進的研究成果が円滑に実用化され、迅速な社会貢献に発展する循環をサポートできることを目指しています。