あれ?hASCは医科学的にも利用されているのであれば、“未知の細胞”ではないのでは?そう思われることでしょう。実は、精確にはhASCはみつかっていないのです。
臨床利用されているhASCも含め、殆どのhASCは、間質細胞(mesenchymal stromal cells :MSC)の多分化能を定義するための最小限の基準にそって調整された粗い細胞集団なのです。その基準とは、(1) 標準的な培養条件細胞の維持にプラスチックへ付着性が必要なこと、(2) 細胞の表面にCD105分子, CD73分子およびCD90分子を発現しつつ、CD45分子とCD34分子、およびCD14分子もしくはCD11b分子かCD79α分子、もしくはCD19分子かHLA-DR分子は発現していないこと、最後に、(3) 骨芽細胞、脂肪細胞、軟骨芽細胞に分化する能力を有すること、以上の3つを満たすことです(国際細胞治療学会のポジションペーパー基準:Cytotherapy (2006)_8(4)_p315-7)。実は、一般的な方法で脂肪組織から抽出されるhASCについて、その全てがこの基準を満たしているわけではありません。つまり、現状のhASCとは粗野な幹細胞集団であると言えます。一方私達は、ポジションペーパー基準に当てはまる細胞は、脂肪組織のみならず皮膚臓器のなかにも存在することも発見しました(Scientific reports 9(1) 18371-18371, 2019)。これらの事実は、hASCとは何処にいて何をしているのか、いったいhASCとは何なのか、といった様々な疑問を生じさせ、hASCの本質を突き詰める研究に集約されます。
研究テーマ1-ヒト間葉系幹細胞の性質の解明
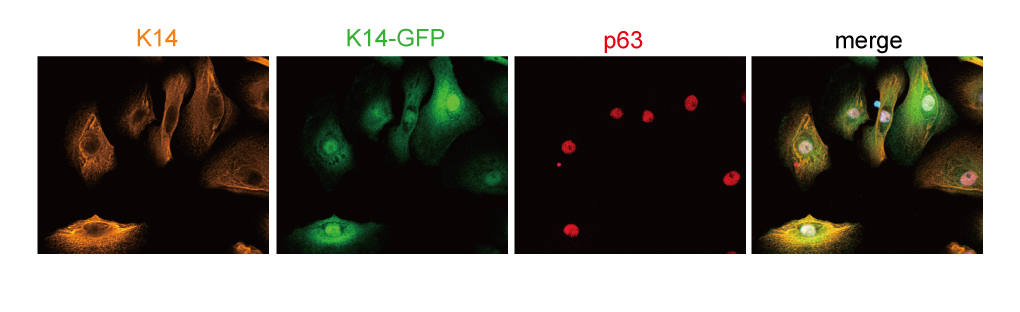
私たちは、皮膚の恒常性維持に欠かせない細胞種として、幾つかの“未知の細胞”に着眼しています。現在、そのターゲットとして着目しているのが、ヒト脂肪組織に含まれると想定されている間葉系幹細胞(hASC: human Adipose-derived Stromal/Stem Cell)です。「間葉系幹細胞」は、ヒト体性幹細胞(組織幹細胞)の一種であり、骨髄幹細胞などは実用化も進んでいるなど、医科学的な価値の高い幹細胞も含まれます。このような間葉系幹細胞のひとつがhASCです。hASCは、脂肪、骨、軟骨などの間葉系組織みならず、神経、肝臓、膵β細胞、心筋などの内・外胚葉系組織など含む、さまざまな細胞に分化する能力を有していることが分かっています。また、ヒトがもつ様々な脂肪部位(皮下脂肪など)より、大がかりな採取を経ることなく低刺激な様態(低侵襲性)にて、数的にも大量に分取できるといった利点があります。 そのため、例えば、細胞再生治療の原材料として、創薬の被検細胞として、美容医療の細胞原材としてなど、有用性のみならず実用性が最も高い幹細胞種と位置づけられているのです。 hASCの真の正体、hASCの真の性質は未だ全く解明されていないというのが現状です。私たちは、皮膚臓器を用いて、この不確かさのひとつひとつを明らかにすることで、hASCの正体を見つけ出す間葉系幹細胞生物学の基礎研究を続けています。また、その歩のなかで得た成果を実用化研究に橋渡しする革新的な再生医療研究も推進しています。
hASCの真の正体、hASCの真の性質は未だ全く解明されていないというのが現状です。私たちは、皮膚臓器を用いて、この不確かさのひとつひとつを明らかにすることで、hASCの正体を見つけ出す間葉系幹細胞生物学の基礎研究を続けています。また、その歩のなかで得た成果を実用化研究に橋渡しする革新的な再生医療研究も推進しています。
Task 1. より質の高いヒト脂肪由来間葉系幹細胞の樹立を目指す
真のhASCが見つけられない背景のひとつに、生体から取り出したhASCを含む集団が理想的に培養できない=維持できないという問題があります。これは前述したポジションペーパー基準の(1)に矛盾するように映りますが、事実、一般的な方法で採取し、一般的な方法で培養を続けたhASC集団は線維芽細胞様化していく傾向があります。線維芽細胞とは、皮膚の真皮層にも存在する細胞で、例えば肌を構成するタンパク質群(コラーゲン、ヒアルロン酸、エラスチン)を作り出す機能をもつなど、肌のハリや潤いを保つ働きにも寄与する終末分化細胞です。このような事実は、hASCが線維芽細胞の供給元(幹細胞?)である可能性も示唆しますが、精確なhASCを見つける(同定する)ことができない限り、疑問符のままです。さらにこの事実は、生体から取り出したhASCの維持法(培養法)の難しさも顕しています。
私たちは、生体内で最も高い活性状態を維持するhASCを取り巻いている環境要因に着目しています。例えば、生体内におけるhASCが受けるストレス(酸素濃度、栄養および浸透圧などによる環境ストレス等)、これらがhASCの増殖能や未分化性維持にどのような影響を及ぼすかについて精緻に解析しています。hASCを取り巻く体液や細胞間における酸素濃度の観点に着目した研究では、より厳密に酸素濃度(溶存酸素濃度)をコントロールすることで、hASCの増殖性、未分化性が著しく向上すること、およびそれらの制御分子の存在を見出しました(Stem Cells Dev. 23(18):2211-24 (2014)、特開2014-030423)。この新技術は間葉系幹細胞を利用した再生医療の治療の現場にも活用されるなど、臨床への実用化への橋渡し基礎研究の成果としても認められています。そして、この革新的培養法により生体外培養の問題点の一部が改善できたことにより、生体の脂肪組織との比較やや皮膚臓器との関係性との検討など、多角的な実験が可能となり真のhASCの探索が着実に進行しています。
Task 2. 間葉系幹細胞のもつstemness、未分化性維持、多分化能メカニズムの解析
生体内ストレスおよび生体内環境要因に曝された幹細胞の中ではどのような現象が引き起こされているのか。それは、生体内という至適な環境に存在するhASCにおいて、本質的にどのような意味をもっているのか。私たちはそのメカニズムを探るべく、in vitro解析はもちろんのこと、ex vivo解析としての組織培養、新規の3次元皮膚皮下組織構築培養、in vivo解析としてのマウスエンジニアリングなどを駆使し、幹細胞が本来有する能力・幹細胞内+外(生体内環境)のダイナミズムを明らかにしていく研究をおこなっています。生体内環境で重要な要素である酸素濃度の変動域それにともなうpH変化などについて、そのプロファイルを取得しています。また、メタボローム解析やトランスクリプトミクスなどのオーム解析から、この現象を制御する可能性のある因子をしぼりこんでおり、現在、その解析と生物学的理論を立証する研究が進められています。さらに、ヒト間質血管細胞群(Stromal Vascular Fraction: SVF)フラクションのシングルセル解析、ならびにトランスクリピトーム解析などから、真のhASCの発見に繋がるマーカーの探索や、線維芽細胞などの類似細胞との比較解析による亜集団化の峻別なども行っています。これらにより、遺伝子組換えマウスを用いた詳細な解析のためのツールの作成も可能となりつつあり、真のhASCの同定に欠かせない因子の特定がさらに加速しています。
現在までに明らかとなった重要な因子の一つがNotchシグナルです。実際にhASCを生体内と同等の変動溶存酸素濃度域で培養すると、解糖系が更新することが認められました。このとき、これらのhASC集団では、一様に低酸素応答因子HIF非依存的なNotchシグナルの活性化が引き起こされることを見出しました。詳しい解析の結果、Notchシグナルは解糖系亢進に関与するトランスポーター等の発現上昇、解糖系抑制に関与する酵素群の発現抑制に関与することが明らかとなりました。これらは、Notchシグナルによるp53シグナル経路の抑制、NF-κBシグナルの活性化、HIFの転写活性亢進により制御されていたのです。このとき実験で明らかにしたhASCの細胞内で起こっている現象を下図に示します。この図が示しているように、hASCが生体内で細胞としてのアイデンティティを維持するのに、Notchシグナルは非常に重要な役割を担っていますこの多彩で複雑なNotchシグナルカスケードににより、代謝を一定に保つ細胞内の恒常性が維持され、hASCの幹細胞性の制御や維持に関与しているということがわかりました(Stem Cells Dev. 27(13): 935-947 (2018))。
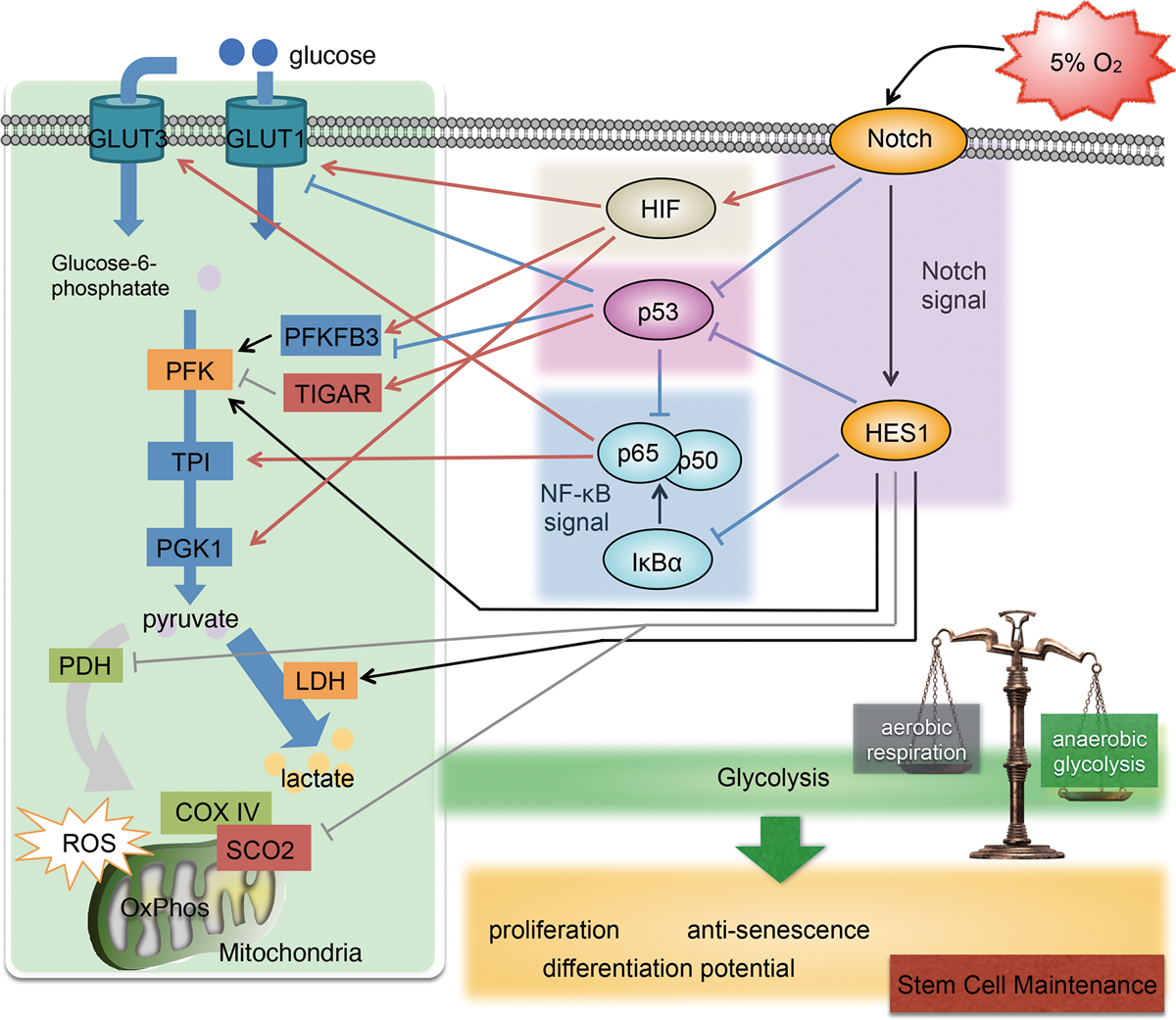
このように、幹細胞の持つ特性を分子基盤として提唱し、臨床の現場で安心・安全・操作性・フットワークの最良な”使える幹細胞”を提供することにつなげていくことを目指します。同時に、この研究から導き出される成果物は、難病や難治性疾患に対する創薬ターゲットの切り口および、時間空間的に最適な創薬研究資材を提供することに直結すると期待しています。
Task 3. 遺伝子導入を利用した、分化誘導法の開発
真のhASCの探索には、その機能を測る実験ツールの製作も欠かせません。hASCの候補細胞特異的に分化誘導因子やマーカー等の遺伝子などを高効率に導入することは必要不可欠です。同時に、このようなシステムは、例えばhASCを活用できる細胞治療や、病態の改善に有用な細胞を製作すことも可能になります。そこで、我々はhASCに効率良く導入出来、発現誘導が可能なレンチウイルスベクターも新規に開発しました(Plos ONE, 8(6): e66274. (2013))。
実際、このレンチウイルスベクターを利用して膵臓のインスリン産生細胞やドパミン産生細胞などを作り出すことに成功しています (Cell journal, 24(12) 705-714, (2022) )。現在、糖尿病、パーキンソン病治療に役立つ治療用の機能性細胞の開発・改良にも着手しており、膜リピド型の新規ベクターシステムの創製や時間空間制御型の安全性の高いベクターの創製も進めています。このように、真のhASCの探索に係る研究技術開発についても、再生医療等実用化の橋渡しの成果につなげています。
Task 4. hASCを用いた皮膚再構成
これまでの研究から、hASCはそれが局在する皮下組織である脂肪組織内の恒常性の維持ばかりか、皮膚組織の恒常性をサポートする重要な働きを担うことが明らかになりつつあります。このような皮膚の恒常性におけるhASCの役割を証明するために、後述する私たちの皮膚科学研究技術を活かし、hASC亜種から皮膚を再構成するための研究にも取り組んでいます。
hASCを真皮代替品、hASCより分化誘導した脂肪細胞を皮下組織代替品とした皮膚三次元モデルの構築を試みています。現在までに、hASC、脂肪細胞を皮下組織代替品とした三次元構築モデルでは、表皮の厚みが有意に増加することを見出しており、hASCがヒト表皮角化細胞どのような影響を与えるのか、詳しく解析を進めています(Scientific reports, 9(1) 18371-18371 (2019)・企業との共同研究)。解析には新規3次元バイオプリンティング技術も活用しています。この技術は、従前の積層化(レイアップ)を主体としたビルトアップ式の技術にのみ頼るのでなく、hASC亜種の分化誘導や線維芽細胞が疑似組織内で自主的な移動(自由局在)行う技術などをハイブリッドに組み併せたものです。そのため、両面培養法や気相-液相培養などを複合的に組み入れつつ、かつ、最短にして最良になるようにカスタマイズすることが重要になります。その為のバイオ素材や生体に馴染む安全性の高い機材、液性因子などを慎重に選定し、アップデートを重ねています(THE CHEMICAL TIMES (266) 2-8 2022)。このような人工皮膚構築の実験系は、hASCの機能評価のみならずhASC亜種群の評価・選別にもたいへん有用です。口述する皮膚科学研究とこの研究内容の融合は、細胞ー組織生物学的な意義なみならず、機能性人工皮膚の開発や代替皮膚医療、先端的ウェアラブルデバイスの開発にもつながることが期待されています。
hASCはさまざまな細胞に分化する能力を秘めていると報告されています。そのため、皮膚構成細胞、例えばメラノサイトやケラチノサイト、神経、血管内皮細胞をhASCによって補完することも可能であると考えられます。また、hASCを含む間葉系幹細胞(MSC)投与により、MSCが損傷部位に遊走され、ケラチノサイトや血管内皮、筋繊維芽細胞などに分化することで、創傷治癒に寄与するという報告もあります。このようなhASCをひとつの原材料として皮膚構成細胞をパーツとして誘導できれば、個々人に応じたオーダーメイドの細胞および皮膚組織の提供も可能となるかもしれません。ただし、直接的に分化させることが可能であっても、現段階ではiPS細胞のような分化効率には至らないのが実情です。そこで、まずはiPS細胞の出番です。hASCは未分化であり、増殖が早く、患者さんから低侵襲性にて採取できるため、iPS細胞の材料としても魅力的です。
私たちは、皮膚疾患患者さん由来iPS細胞をhASCより樹立し、メラノサイトやケラチノサイトへの分化誘導にも成功しています。現在は、正常な表皮角化細胞をより効率よく分化誘導するための研究を進めています(大阪市立大医学部との共同研究)。